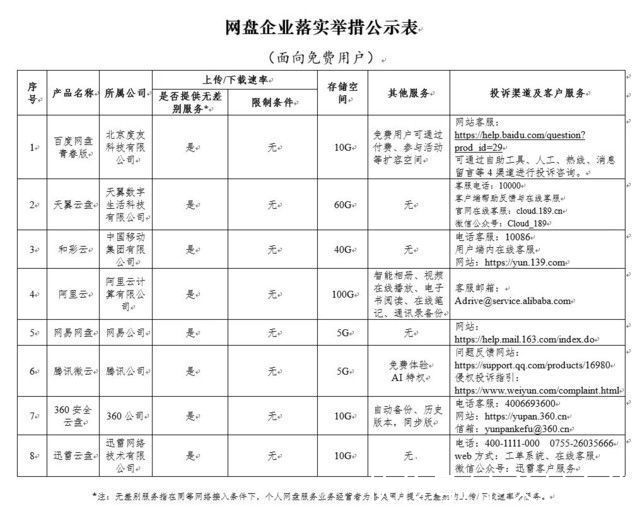
fda|20天从申请到获批!FDA新试点项目加速抗癌药审评
▎药明康德/报道
今日,美国FDA批准诺华(Novartis)的Kisqali(ribociclib)与芳香酶抑制剂(aromatase inhibitor,AI)联合作为初始内分泌治疗,用于罹患激素受体(HR)阳性、人表皮生长因子受体2(HER2)阴性晚期或转移性乳腺癌的绝经前或后女性 。FDA还批准Kisqali与氟维司群(fulvestrant)联合作为初始内分泌治疗或疾病进展后内分泌治疗,用于罹患HR阳性、HER2阴性晚期或转移性乳腺癌的绝经后女性 。
值得一提的是,这是FDA作为在今年早些时候宣布的两个新试点项目的一部分而授予的首个批准 。这两个试点项目为实时癌症审评(Real-Time Oncology Review)和新的模板化评估援助(Assessment Aid) 。前者使FDA在临床试验结果正式提交前即开始审评;后者则方便申请公司用结构化的格式进行提交,加快FDA的审评 。这些措施旨在使癌症药物的研发和审评更加有效,同时改进FDA评估疗效和安全性的严格标准 。通过这种实时审评,FDA能够在试验结果出现后立即开始评估临床数据,使FDA能够在提交正式申请时做好批准的准备 。
乳腺癌是美国最常见的癌症形式 。美国国立卫生研究院(NIH)的国家癌症研究所(NCI)估计,今年将有大约266,120名女性被诊断为乳腺癌,其中40,920名将死于该病 。大约72%的乳腺癌患者具有HR阳性和HER2阴性的肿瘤 。她们需要有效的治疗来缓解疾病 。
本文来源:药明康德
Kisqali是一种选择性细胞周期蛋白依赖性激酶抑制剂,是一类通过抑制两种细胞周期蛋白依赖性激酶4和激酶6(CDK4/6)来帮助减缓癌症进展的药物 。当这些蛋白被过度激活时,可使癌细胞生长和分裂得太快 。以较高的精确度靶向CDK4/6有望避免癌细胞不受控制地复制 。该药物于2017年3月首次获批与芳香酶抑制剂联合治疗罹患HR阳性、HER2阴性晚期或转移性乳腺癌的绝经后女性 。

文章图片
▲Kisqali(ribociclib)是一种CDK4/6抑制剂(图片来源:《Nature Reviews》)
Kisqali与芳香酶抑制剂联合治疗绝经前或后女性的疗效在包含495名患者的临床试验MONALEESA-7中得到证实 。该研究中的所有患者均接受了戈舍瑞林(goserelin)的卵巢抑制 。结果显示,与接受安慰剂加芳香酶抑制剂的患者相比,接受Kisqali加芳香酶抑制剂的患者的中位无进展生存期(PFS)更长(13.8个月比27.5个月) 。
Kisqali联合氟维司群治疗晚期或转移性乳腺癌的疗效也在包含726名患者的临床试验MONALEESA-3中得到验证 。结果显示,与接受安慰剂加氟维司群的患者相比,接受Kisqali加氟维司群的患者的中位PFS更长(12.8个月比20.5个月) 。
“通过这项批准,我们已经证明了我们正在试用的审评癌症药物新项目的一些好处,可以提高监管效率,同时加强数据评估的过程 。这表明,通过智能政策的方法,我们可以在提高效率的同时提高流程的严谨性 。这些新项目旨在减少一些可能增加审评时间和成本的行政问题,包括FDA的人员配置负担 。例如,通过在正式提交给FDA之前更早地分析数据,以及在结构化模板中评估提交的数据,我们可以更容易地更早识别在申请中缺少的可能延迟审评的关键分析或信息,“FDA局长Scott Gottlieb博士表示:“经过今天的批准,FDA使用这些新方法使审核小组在实际提交申请之前开始分析数据,并帮助指导公司对顶线数据的分析,以梳理出最相关的信息 。这使我们在6月28日提交后不到一个月就批准了该疗法,比目标日期提前了几个月 。”
参考资料:
[1] FDA approves first cancer drug through new oncology review pilot that enables greater development efficiency
推荐阅读
- 遗传|从“母亲”那遗传来的抗压能力,算不算外挂?
- 美国_财经|从卫生纸到电子产品美国网购全线涨价 中国出口企业下半年挑战大
- 结石|从来没痛过的结石,把我的肾脏搞坏了!
- 双眼皮|老年人去整形:从双眼皮修复到脸部热玛吉,老了,才更想变美
- 急诊科|从抢救室到手术室,短短有几分钟的路,却如此艰难!
- 恒瑞|从恒瑞命运看中国创新药之现实
- 药企|跨国药企在华40年:从超国民待遇到普通玩家
- 医生|“五朵金花”:从五名女博士的奋斗,读懂医生向上的力量!
- 糖尿病|糖尿病1型和2型有什么区别?从4点剖析,糖友要搞清楚,对症治疗
- 养生|【天天养生】夏季养心肺药膳方,从主食炒菜到汤水都齐了!